汞在水环境中的形态
水体中汞(<1ppb)以:Hg2+、Hg(OH)2、CH3Hg+、 CH3Hg(OH)、 CH3HgCl、 C6H5Hg+
悬浮物中汞以:Hg2+、HgO、HgS、CH3Hg(SR)、 (CH3Hg)2S
生物体中汞以:Hg2+、 CH3Hg+、 CH3HgCH3
在还原状态下,汞还会以蒸气态的形式进入大气。
水体中的悬浮物和底质对汞有强烈的吸收,并在微生物的作用下,转化为甲基汞。
铅在水环境中的形态
淡水中铅的含量为0.06~120ppb,中值为3ppb。
存在形态:Pb2+、Pb(OH)2、Pb(OH)3-、PbCl+、PbCl2。
在中性或弱碱性环境中,铅的浓度受到Pb(OH)2 的限制;
在酸性环境中,铅的浓度受到PbS 的限制。
水中的悬浮物和沉积物对铅有强烈的吸附作用,故其迁移力很弱。
砷在水环境中的形态
淡水中砷的含量为0.2~230ppb,中值为1.0ppb。
存在形态:H3AsO3、H2AsO3-、H3AsO4、 H2AsO4-、 HAsO42-、 AsO43-、
在适宜的Eh和pH呈中性的水中,砷以H3AsO3为主,但在中性或弱酸性富氧水体中则以H2AsO4-、 HAsO42-为主。
砷可被颗粒物吸附、共沉淀而沉积到底部沉积物中,水生生物可富集无机和有机砷化合物。砷还可被甲基化,但其的毒性仅为砷酸钠的1/200。
铬在水环境中的形态
镉在天然水中的形态
含量为:1~40ppb。
存在形态:Cr3+、CrO2-、CrO42-、Cr2O72-
三价态的铬大多数被底泥吸附转入固相,迁移能力弱。
六价态在碱性环境中稳定存在,并为溶解态,迁移能力强。
Cr(VI)的毒性>Cr(III),其还原作用受到DO、BOD5、CODCr的影响。
铜在水环境中的形态
铜在天然水中的含量为:3ppb。
存在形态:受Cl-、OH-、CO32-等浓度的影响
pH在5~7时,以Cu2(OH)2CO3溶解度最大,Cu2+存在较多。
pH>7时,CuO的溶解度最大,则以Cu2+、CuOH+为主。
pH>8时,则Cu(OH)2、Cu(OH)3-、CuCO3、Cu(CO3)22-为主。
水中的无机和有机粒子可强烈吸附或螯合铜离子,使铜进入沉积物。
水中无机污染物的迁移转化
一、颗粒物与水之间的迁移
1、水中的颗粒物
2、水环境颗粒物的吸附作用
3、沉积物中重金属的释放
二、水中颗粒物的聚集
1、胶体颗粒凝聚的基本原理和方式
2、胶体颗粒絮凝动力学
三、溶解和沉淀?
四、氧化和还原?
五、配合作用?
水环境颗粒物的吸附作用
表面吸附——物理吸附
离子交换吸附——物理化学吸附
专属吸附——处理化学吸附之外还有加强的憎水键、氢键、范德华力等作用的。再吸附的过程中,表面的电荷会发生变化,吸附同号的电荷。特性
如:水合氧化物对金属离子有较强的专属吸附能力。
沉积物中重金属的释放
沉积物中重金属的释放属于二次环境问题,对水生生态系统以及饮用水来说都是危险的。
盐浓度升高
氧化还原条件的改变——河口、湖泊、进岸处,有机物增加,氧化还原点为降低,使铁锰氧化物还原、溶解,从而释放其吸附的金属离子。
酸度的增加,pH降低
配合剂的增加
水中颗粒物的聚集
1、胶体颗粒物凝聚的原理和方式
凝聚 絮凝
典型的胶体的相互作用是以DLVO物理理论为定量基础的,仅考虑范德华力和扩散双电层排斥力。
适用条件:没有化学专属吸附;颗粒是均匀的球体形状。
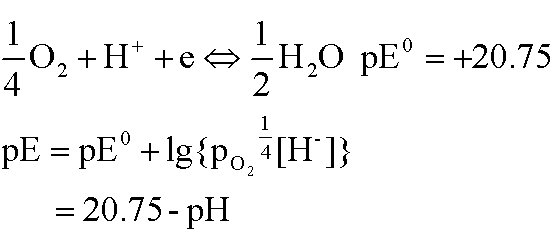
溶解和沉淀
溶解和沉淀的过程是污染物迁移的重要途径。
利用溶解与沉淀平衡计算的结果与实际情况却相差甚远,原因在于:
一些非均相平衡进行的很慢,难以达到平衡状态;
稳定固相并不是唯一的,如硅可形成蛋白石、石英;
体系存在过饱和的现象
固体溶解后的离子会继续参加某些反应;
氧化—还原
水体的氧化还原特性,决定了水中溶质的性质。
电子活度和氧化还原电位
在氧化还原体系中,氧化剂和还原剂实际上就是电子的接受体和给予体。
而水溶液中电子的活度αe可以在20个数量级的范围内发生变化。
定义:pE=-log (αe)
水的氧化限度:
水的还原限度:
2、天然水的pE-pH图
水的氧化还原限度
3、天然水的pE和决定电位
天然水的pE 一般天然水的决定电位由溶解氧决定,而在有机物积累的厌氧环境中,则有机物成为决定电位的物质。
水中的氧化剂:溶解氧、Fe(III)、Mn(IV)、S(VI)
水中的还原剂:有机化合物、Fe(II)、Mn(II)、S(-II)
在水体的混合体系里,氧化还原电位有谁决定?
若某个单体系的含量比其他体系高得多,则此时该单体系电位几乎等与混合体系的电位。
4、无机氮化物的氧化还原转化
5、无机铁的氧化还原转化 以Fe3+-Fe2+-H2O为例:设:总溶解铁浓度为1.0×10-3mol/L
pE<<pE0,[Fe3+]<<[Fe2+] , [Fe2+]=1.0×10-3 mol/L
lg[Fe3+]=pE-16.05
pE>>pE0,[Fe3+]>>[Fe2+] , [Fe3+]=1.0×10-3 mol/L
lg[Fe2+]= 10.05- pE
6、水中有机物的氧化 当进入水体的有机物不多时,其耗氧量没有超过水体中氧的补充量,则溶解氧保持在一定的水平;当有机物大量进入水体中,消耗大量的溶解氧,致使溶解氧来不及补充,会溶解氧急剧下降,甚至导致缺氧或无氧,有机物则进入无氧分解阶段,产生还原性物质,使水质进一步恶化
配合作用
金属元素进入水体后,往往以配合物的形态存在。并且其存在的形态还会影响其毒性。
天然水中重要的无机配位体:
OH-、Cl-、CO32-、HCO3-、F-、S2-等
有机配位体:比较复杂,有植物的降解产物,如氨基酸、糖、腐殖酸,洗涤剂、清洁剂、农药、EDTA等。
1、配合物在溶液中的稳定性 配合物在溶液中的稳定性指配合物在溶液中离解成中心离子和配位体,当理解达到平衡的时候理解程度的大小。
配合物的稳定常数可以用来衡量配合物的稳定性。
当有多个配位体时,其过程可用累积稳定常数来表示。
2、羟基对重金属离子的配合作用1
2、羟基对重金属离子的配合作用2
2、羟基对重金属离子的配合作用3
3、Cl-对重金属离子的配合作用
4、腐殖质的配合作用 腐殖质——有机高分子物质,分子量300~30000 可分为:
腐殖酸:Humic Acid,溶于稀碱,不溶于酸,分子量数千到数万;
富里酸:Fulvic Acid,溶于酸和碱,分子量数百至数千;
腐黑物:Humin,不溶于酸和碱。
腐殖质的特点 腐殖质能起络合作用的是各种含氧官能团,如-COOH、-OH、-C=O、-NH2等。
各种无机、有机配位体与重金属生成的络合物和螯合物可使重金属在水中的溶解度增大,导致沉积物中重金属的重新释放。重金属的次生污染在很大程度上与此有关。
腐殖质能与金属离子形成一般的配合物和螯合物。并且还会引起其毒性的改变。
水中有机污染物的迁移转化
分配作用
沉积物中有机化合物的分配系数与沉积物中有机碳的含量呈正比(当有机物的含量在5~40%之间时)。
也就是说水中的颗粒物从水质吸附憎水有机物的量,与颗粒物中有机质的含量密切相关。
由于不同的沉积物有机质含量不同,分配系数就很难以对不同的沉积物的“吸附能力”作比较,因此引出“标化分配系数”
挥发作用 Volatilization
挥发作用,volatilization. 是有机物质从溶解态转入气相的一种重要迁移过程。
速率常数的值依赖于:KL、KH和Kg
当KH >1.013×102 Pa•m3/mol, 受液膜控制。
当KH <1.013 Pa•m3/mol,挥发作用受气膜控制。
亨利系数的估算公式
挥发作用的双膜理论
挥发速率常数
水解作用 Hydrolysis 水解作用,hydrolysis,是污染物与水之间的重要的反应。在反应汇中化合物的官能团X-与水中的OH-发生交换作用。
对大多数化合物来说,水解作用是其在环境中消失的重要途径,水解作用还改变了化合物的原有的结构。
但是水解作用并不一定能降低化合物的毒性。
水解速率常数 一般来说,水解反应是一级反应,因此其水解速率表达式可写成:
D[ RX]/dt=Kb[ RX] Kb水解速率常数
当该物质水解至一半时,所消耗的时间,即水解的半衰期与其初始浓度无关。
光解作用,photolysis,是有机物真正的分解过程,因为它是不可逆地改变了化合物的结构,并强烈的影响了水环境中一些污染物的归趋。
光解作用 Photolysis
1 直接光解
2 光敏化反应:水中存在的天然有机物,被阳光激发后,将其能量转移给了某些化合物使其被激发,并导致其分解的过程。
3 氧化反应:天然物质在阳光辐射下,产生自由基或纯态氧等中间体,是化合物被氧化。
水解速率受pH 的影响
水环境中光的吸收: 太阳的辐射是恒定的,但是大气中的颗粒物使其强度发生了变化,而大气的吸收还改变了其谱线的分布。
水环境中光的吸收
光量子产率
液相中的光量子产率 液相中的光量子产率的两种性质:光量子产率小于1,光量子产率与波长无关。
对于一个化合物来说,是恒定的,对多种化合物来说,在阳光波长范围内,也是不变的。
光解速率的表达 应用污染物光化学反应的半衰期的概念,是测定光解速率的间变得方法。
敏化作用 敏化作用:当一个光吸收分子将其多余的能量转移到一个接受体分子,导师接受体反应的过程。 2,5-二甲基呋喃的光敏化降解就是一个例子。
20世纪70年代,S.N.Frank首次提出了用半导体材料用于催化光解水中的有机污染物。
氧化反应 水中常见的氧化剂为:单重态氧 烷基过氧自由基 烷基自由基 羟基自由基
生物降解作用
两种 生长代谢
生长代谢 以有机毒物作为唯一的碳源
模式 有明显的滞后期,2~50天
共代谢
有机毒物不能作为唯一的碳源与能源 无滞后期 降解的速度较完全驯化的生长代谢慢
第五章
学习的内容
土 壤 概 述 土壤处于岩石圈最外面的一层疏松的部分,具有支持植物和微生物生长繁殖的能力,被称为土壤圈。
土壤圈是处于大气圈、岩石圈、水圈和生物图之间的过渡地带,是联系有机界和无机界的中心环节。
成土因素综合作用的不同,产生出多种类型的土壤。
土壤的成土过程
土壤的基本环境功能
土壤退化的过程 风和水的侵蚀作用:引起土壤流失;
受纳酸雨或过多使用氨氮肥料: 引起土壤酸化;
灌溉水中含过多盐分或深度风化作用:引起土壤盐碱化;
干旱: 引起土壤板结、龟裂、结构单元破坏甚至荒漠化;
水涝: 引起营养物浸出和流失;
污染: 引起土壤中有毒物质累积。
土壤环境质量标准 国家环境保护局于1995年制订和发布了《土壤质量环境标准》GB15618一1995,其适用范围包括我国疆域内所有农田、蔬菜地、茶园、果园、牧场、林地、自然保护区等地的土壤。
土壤环境质量标准
一级标准
适用于I类土壤区,包括国家规定的自然保护区(原有背景重金属含量高的除外)、集中生活饮用水源地、茶园、牧场和其他保护地区的土壤。土壤质量应基本上保持自然背景水平。
二级标准
适用于Ⅱ类土壤区,包括一般农田、蔬菜地、茶园、果园、牧场等的土壤。土壤质量应基本上对植物和环境不造成危害和污染。
三级标准
适用于Ⅲ类土壤区,包括林地土壤及污染物容量较大的高背景值土壤和矿区附近等地的农田土壤(蔬菜地除外)。
土壤质量应基本上对植物和环境不造成危害和污染
土壤的组成与性质 土壤由固、液、气相物质组成:
固相指土壤矿物质(原生矿物和次生矿物质)和土壤有机质,两者占土壤总量的90~95%。
液相指土壤水分及其可溶物,两者合称为土壤溶液。
气相指土壤空气。
土壤中还有数量众多的细菌和微生物,一般作为土壤有机物而视为土壤固相物质。
土壤的固、液、气相结构
土壤剖面 Soil profile
土壤的组成 土壤矿物质 土壤有机质 土壤水分 土壤空气
1 土壤矿物质Soil mineral
按成因类型可将土壤矿物分为两类:原生矿物和次生矿物
原生矿物 是各种岩石主要趋岩浆岩受到程度不同的物理风化而未经化学风化的碎屑物,其原来的化学组成和结晶构造都没有改变
次生矿物 大多数是由原生矿物经风化后重新形成的新矿物,其化学组成和构造都有所改变而不同于原来的原生矿物。
在土壤形成过程中,原生矿物以不同的数量与土壤中的次生矿物混合存在,成为土壤矿物质。
原生矿物 (1)硅酸盐类矿物 长石类、云母类、辉石类和闪角石类等矿物,容易风化而释放出K、Na、Ca、 Fe、 Mg、 Al等元素可供植物吸收,同时形成新的次生矿物。
(2)氧化物类矿物 石英(SiO2)、赤铁矿(Fe2O3)、金红石(TiO2)、蓝晶石(Al2SiO5)
(3)硫化物类矿物 土壤中通常只有铁的硫化物,即黄铁矿和白铁矿,二者是同质异构物,分子式均为Fe2S极易风化,成为土壤中硫元素的主要来源。
(4)磷酸盐类矿物 土壤中分布最广的是磷灰石,包括氟磷灰石和氯磷灰石两种,其次是磷酸铁、铝以及其它磷的化合物,是土壤中无机磷的重要来源。
土壤的次生矿物 简单盐类 三氧化物类 次生铝硅酸盐类
2 土壤的有机质
土壤有机质(Soil Organic Matter)包括:
(1) 非特殊性的土壤有机质,包括动植物残体的组成部分以及有机质分解的中间产物,例如蛋白质、树脂、糖类、有机酸等,占土壤有机质总量的10~15%。
(2) 土壤腐殖质,是土壤特有的有机物质,占土壤有机质总量的85~90%,主要是动植物残体通过微生物作用,发生复杂转化而成。其主要组成为:胡敏酸、富里酸、胡敏素
有机质来源︰生物残骸,包括植物、动物、细菌、真菌等。
有机质的功能︰维持土壤构造,使之疏松不粘、提供矿物质以及有机氮与磷、保水、保阳离子。
有机质的含量︰土壤依含量分为矿质(0-10%)、腐泥(10-40%)与泥炭(10-100%)。
3 土壤水分
4 土壤空气
土壤孔隙中所存在的各种气体的混合物称为土壤空气。
以O2、N2、CO2及水汽等为主要成分;其次由于土壤进行生物化学作用产生的气体。如H2S、NH3、NO2、CO等;另外一些醇类、酸类以及其它挥发性物质通过挥发作用也进入土壤。
5土壤生物植物︰
活根释出有机酸以及CO2,可加速土壤矿物的溶解。
细菌︰可分解有机质、固氮(固氮菌),但土壤也含有病原菌。
真菌︰可分解有机质。根菌(mycorrhiza)着生于作物根部,有助于根的吸收养分。
藻类︰土壤表面可能有绿藻或蓝绿藻。
动物︰原生动物如变形虫、纤毛虫、鞭毛虫数量庞大,对于分解有机值贡献颇大。
土壤的粒级分组和粒级划分土壤矿物质的粒级划分
按粒径的大小将土粒分为若干组,称为粒组或粒级。
粒级的划分标准及详细程度主要有三种不同的划分,即国际制、前苏联制和美国制。
土粒分级标准
我国的土粒分级标准
各粒级的主要矿物成分和理化特性
各粒级的物理化学性质
土壤的各个不同粒级的差异仅仅在于粒径的大小吗? 其实,土壤的粒径的不同,其矿物成分和化学组成也会不同,各粒级表现出来的物理化学性质和肥力特征也不同。
各粒级的物理化学特征
粘粒 主要是次生矿物,粒径小于0.001mm。含粘粒多的土壤,营养元素含量丰富,团聚能力较强,有良好的保水保肥能力,但土壤的通气和透水性较差。
粉粒 原生矿物有云母、长石、角闪石等。次生矿物有次生石英、高岭石、含水氧化铁、铝,其中次生石英较多。粒径为0.05~0.005mm。其物理及化学性状介于砂粒与粘粒之间。团聚、胶结性差,分散性强。保水保肥能力较好。
砂粒 主要为原生矿物,大多为石英、长石、云母、角闪石等,其中以石英为主,粒径为1~0.05mm。在冲积平原土壤中常见。
石块和石砾 多为岩石碎块,直径大于lmm。山区土壤和河漫滩土壤中常见。
土壤质地分类及其特性
土壤中最活跃的组分:土壤胶体和土壤微生物。
1、土壤胶体(soil colloid )的性质
(1) 土壤胶体具有巨大的比表面和表面能
物质的比表面越大,表面能也越大。
(2) 土壤胶体的电性
土壤胶体微粒具有双电层,微粒的内部称微粒核,一般带负电荷,形成一个负离子层(即决定电位离子层),其外部由于电性吸引,而形成一个正离子层(又称反离子层,包括非活动性离子层和扩散层),即合称为双电层。
(3) 土壤胶体的凝聚性和分散性
2、土壤胶体的离子交换吸附
在土壤胶体双电层的扩散层中,补偿离子可以和溶液中相同电荷的离子以离子价为依据作等价交换,称为离子交换(或代换)。
