生物化学复习笔记
1.静态生化-结构和催化作用
1.1 氨基酸、多肽和蛋白质
1. 部分氨基酸的特殊性质蛋白质中的氨基酸都是L 型的,D 型仅存在于细菌细胞壁上的小肽或抗菌肽中;只有Ile 和Thr 有两个手性碳原子,Gly 是唯一不含手性碳原子的AA,因此不具旋光性;Ser 、Thr、 Tyr,这些AA 残基的-OH 上磷酸化是一个十分普遍的调控机制,可进行可逆性磷酸化,可有效地控制细胞的生长和机体的各种反应;
Asn、Gln 在生理pH 范围内其酰氨基不被质子化,因此侧链不带电荷;
Cys,在pro 经常以其氧化型的胱氨酸存在,-S-S-二硫桥;
His 是唯一一个R 基的pka 值在7 附近的AA,因此在PH7.0 附近有明显的缓冲作用;
Phe:它的浓度的测定被用于苯丙酮尿症的诊断;
Met 又称蛋氨酸,它是体内代谢中甲基的供体。(SAM—S-腺苷蛋氨酸);
A280:Trp、Tyr 和Phe 残基的苯环含有共轭双键;
Trp 显现磷光,是一种寿命较长的发射光,对研究蛋白质结构和动力学特别有用。近年发现谷胱甘肽过氧化物酶中存在硒代半胱氨酸,有证据表明此氨基酸由终止密码UGA 编码,可能是第21 种蛋白质氨基酸。
2. 氨基酸分类 按照R 基的极性性质(能否与水形成氢键)20 种基本aa,可以分为4 类:非极性氨基酸(9 种)、不带电何的极性氨基酸(6 种)、带负电荷的aa(酸性aa,2种)、带正电何的aa(碱性aa,3 种) 酶的活性中心:His、Ser、Cys
3. 氨基酸的化学性质所有的α-AA 都能于茚三酮发生颜色反应生成紫色物质,570nm 测定;Pro 和羟脯氨酸生成亮黄色,440nm 测定;在近紫外区(200-400nm)只有芳香族AA 有吸收光的能力,含有共轭双键的化合物有吸收紫外光的特性,紫外吸收法定量蛋白质的依据;Trp>Tyr>Phe(紫外吸收能力) 在280nm 有最大光吸收。
4. 天然存在的活性肽:
I 谷胱甘肽:Glu—Cys—Gly:红细胞中的巯基缓冲剂,参与氧化还原过程,清除内源性过氧化物和自由基,维护蛋白质活性中心的巯基处于还原状态。
II γ-鹅膏蕈碱:环状八肽,能与真核生物RNA 聚合酶II 牢固结合而抑制该酶的活性,使RNA 合成不能正常进行,但不影响原核生物的RNA 合成。
III 脑啡肽(5 肽) IV 短杆菌肽(抗生素)V 肽类激素: 牛催产素、牛加压素、舒缓激肽
5. 蛋白质一级结构的测定 pro 测定的策略:测定蛋白质分子中多肽链的数目、拆分蛋白质分子中的多肽链、测定多肽链的氨基酸组成、断裂链内二硫键、分析多肽链的N 末端和C 末端、多肽链部分裂解成肽段、测定各个肽段的氨基酸顺序、确定肽段在多肽链中的顺序、确定多肽链中二硫键的位置N-末端和C-末端AA 残基的鉴定
二硫桥的断裂:氧化法(过甲酸)和还原法(巯基乙醇和DTT)。多肽链的部分裂解:①酶裂解法 ②化学裂解法
二硫桥位置的确定:对角线电泳
6. 蛋白质的四个结构层次
重点是超二级结构、结构域。
超二级结构:由两个以上二级结构单元相互聚集形成的有规则的二级结构的组合体如αα、βαβ、βββ; 结构域(domain),又称motif(模块、基序)。在二级结构及超二级结构的基础上,多肽链进一步卷曲折叠,组装成几个相对独立、近似球形的三维实体。结构域是球状蛋白的折叠单位,多肽链折叠的最后一步是结构域间的缔合。结构域间的裂缝,常是活性部位,也是反应物的出入口。一般情况下,酶的活性部位位于两个结构域的裂缝中。
锌指:DNA 结合蛋白中,2 个His、2 个Cys 结合一个Zn
亮氨酸拉链:DNA 结合蛋白中,由亮氨酸倒链形成的拉链式结
7. 稳定蛋白质三维结构的力
非共价键:1、氢键是维持蛋白质三维结构的主要作用力。2、疏水作用(熵效应)在驱动蛋白质的折叠方面占有突出的地位。
共价键:1、肽键 2、二硫键: 对蛋白质的三维结构起到稳定作用,有些二硫键对于维持活性是必需的,有些是非必需的。 绝大多数情况下,二硫键是在多肽链的β 转角附近形成的。 二硫键主要存在于分泌到细胞外的蛋白质中,如核糖核酸酶和胰岛素等。
8. 二级结构的元件
α螺旋及其特征:① 多肽链上连续出现带同种电荷基团的氨基酸 残基,(如Lys,或Asp,或Glu),则由于静电排斥,不能形成链内氢键,从而不能形成稳定的α—螺旋。如多聚Lys、多聚Glu。而当这些残基分散存在时,不影响α—螺旋稳定。② Gly 的Φ 角和Ψ 角可取较大范围,在肽中连续存在时,使形成α—螺旋所需的二面角的机率很小,不易形成α—螺旋。丝心蛋白含50%Gly,不形成α—螺旋。③ R 基大(如Ile)不易形成α—螺旋。④ Pro、脯氨酸中止α—螺旋。⑤ R 基较小,且不带电荷的氨基酸利于α—螺旋的形成。如多聚丙氨酸在pH7 的水溶液中自发卷曲成α—螺旋。
β-折叠及其特征:从能量上看,反平β-折叠比平行的更稳定,前者的氢键NH---O 几乎在一条直线上,此时氢键最强。 在纤维状蛋白质中β 折叠的主要是反平行式的(更稳定),氢键主要是在肽链之间形式; 球状蛋白质中两种方式几乎同样广泛地存在,氢键既可在不同肽链间形成,也可在同一肽链的不同部分间形成。
9. 胶原蛋白
由三股左手α-肽链缠绕成的右手三股螺旋。富含Gly-x(Pro)-y(Hpy),Hyp(4-羟脯氨酸)不易被一般的蛋白酶水解。胶原于水中煮沸即转变成明胶(动物胶)。明胶是一种水溶性的多肽混合物。
10. 别构效应
蛋白的别构部位与效应物的结合改变了蛋白质的构象,从而对活性部位产生的影响,别构效应具有协同性。1、同促效应(发生部位相同):正协同效应:是S 形配体结合曲线;负协同效应:不呈S 形配体结合曲线。2、异促效应(发生部位不同):正效应物(激活剂);负效应物(抑制剂)别构效应物是细胞代谢库的成分,其浓度的细微变化可立即调节代谢需求。
11. 蛋白质的变性和折叠
体内蛋白质折叠:体内蛋白质的折叠需要 PDI(蛋白质二硫键异构酶)、PPIases(肽基脯氨酰异构酶)和分子伴侣。脯氨酰异构化是体内许多蛋白质折叠的限速步骤。
12. 血红蛋白的结构
血红蛋白的氧合曲线(与肌红蛋白比较):血红蛋白由 4 个亚基组成,每个亚基都与肌红蛋白类似,含有一个血红素,都能结合一分子O2 ,四个亚基之间具有协同效应,第一个配基的结合能提高其它亚基对O2 的亲和力。因此,它的氧合曲线是S 型曲线。
协同效应可增加血红蛋白在肌肉中的卸氧量,使它能有效地输送氧气。
波耳效应:增加CO2 的浓度、降低pH 能显著提高血红蛋白亚基间的协同效应,降低血红蛋白对O2 的亲和力,促进O2 的释放,反之,高浓度的O2 也能促使血红蛋白释放H+ 和CO2 。
血红蛋白是一个别构蛋白,BPG 是它的效应物。BPG(二磷酸甘油酸)通过与它的两个β亚基形成盐键稳定了血红蛋白的脱氧态的构象,因而降低脱氧血红蛋白的氧亲和力。
生理意义:BPG 进一步提高了血红蛋白的输氧效率。在肺部,PO2 超过100torr,因此,即使没有BPG,血红蛋白也能被饱和,在组织中,PO2 低,BPG 能降低血红蛋白的氧亲和 力,加大血红蛋白的卸氧量。
(1)高山适应和肺气肿的生理补偿变化;BPG 升高。
(2)血库储血时加入肌苷可防止BPG 的降解。 协同效应、波耳效应、别构效应使血红蛋白的输氧能力达到最高效率。
13. 血红蛋白分子病
镰刀状细胞贫血病、地中海贫血
14. 免疫系统和免疫球蛋白 分为5 类,IgA 、M、D、E、G。IgG 是血液中最丰富的免疫球蛋白。
抗原:是指进入异体机体后,能致敏淋巴细胞产生特异抗体,并能与抗体发生特异结合的物质(主要有蛋白质、核酸及其它高分子化合物)。
抗体:是在对抗原刺激的免疫应答中,B 淋巴细胞产生的一类糖蛋白,它是能与相应抗原特异性结合、产生免疫反应的球蛋白,称免疫球蛋白。 抗体多样性的分子机制。
15. 基于抗体一抗原相互用的生化分析方法:
ELISA 酶联免疫吸附测定、免疫印迹测定或称western blotting
16. 分离纯化的一般原则
17.分离纯化常用技术: 盐溶和盐折(硫酸铵)、超滤、层析原理和类型、电泳技术原理和类型。
1.2 酶
1. 酶作为催化剂的特点:
①易失活;②催化效率高,用量少(细胞中含量低);③高度专一性(与一般催化剂最主要的区别);④酶活性受到调节和控制:A、调节酶的浓度 B、通过激素调节酶活性 C、反馈抑制调节酶活性 D、抑制和激活剂对酶活性的调节 E、其他方式(别构调控,酶原激活等);⑤改变反应速率,加速达到反应平衡但不改变化学反应平衡点;⑥酶的催化活性离不开辅酶、辅基、金属离子。
2. 酶的专一性:“锁与钥匙”学说:认为整个酶分子的天然构象是具有刚性结构的,酶表面具有特定的形状。酶与底物的结合如同一把钥匙对一把锁一样。
诱导契合假说:当酶分子与底物分子接近时,酶蛋白受底物分子诱导,其构象发生有利于底物结合的变化,酶与底物在此基础上互补契合进行反应。
3. 酶的活力测定和分离纯化
酶活力的测定:①酶活力 ②酶活力单位 ③酶活力国际单位(IU 单位)④测定酶活力时,为了保证测定的速率是初速率,通常底物浓度通常很大,使酶饱和;底物消耗≤5%的速率为初速率。⑤酶的比活力:代表酶的纯度,用每mg 蛋白质所含的酶活力单位数表示。比活力=活力U/mg 蛋白=总活力U/总蛋白mg 。⑥酶活力的测定方法:A、分光光度法B、荧光法 C、同位素测定方法D、电化学方法(pH 测定法)
酶的分离和纯化:①酶的分离纯化的进程主要包括:浓缩、除杂。②判断分离提纯方法的优劣,一般用两个指标衡量。A、总活力的回收 B、比活力提高倍数。总活力=活力单位数/ml 酶液×总体积(ml)。比活力=活力单位数/mg 蛋白(氮)纯化倍数 =每次比活力 /第一次比活力。回收率(产率)=每次总活力 / 第一次总活力×100%。③酶溶液浓度越低越易变性,切记不能保存酶的稀溶液。常用的蛋白酶抑制剂:PMSF(甲苯磺酰氟)、亮抑酶肽、抑蛋白酶肽。④酶的提纯过程中,总蛋白减少,总活力减少,比活力增高。
4. 酶的工作机制
为什么酶能够降低反应活化能?过渡态理论。
5. 酶的调节机制
别构调节 (非共价修饰, 可逆):酶分子的非催化部位与某些化含物可逆地非共价结合发生构象的改变,进而改变酶活性状态,称为酶的别构调节。凡是能使酶分子发生别构作用的物质称为效应物。
共价修饰 (可逆):共价修饰的基团主要是磷酸化、腺苷化、尿苷酰化及ADP-核糖基化等。在修饰过程中,酶的活性在无活性(或低活性)与有活性(或高活性)两种状态中改变。共价修饰的互变是由不同的酶催化的,属于酶活性的快速调节
酶原激活 (不可逆):某些活性酶的无活性前体蛋白(如果不是酶,则称某蛋白原),这种前体蛋白经过蛋白水解酶专一作用后,构象发生变化,形成酶的活性部位,变成活性蛋白。活性中心的形成或暴露过程,具有不可逆性。
6. 同工酶
同工酶:是指催化相同的化学反应,但其蛋白质分子结构、理化性质和免疫性能等方面都存在明显差异的一组酶。不同种生物有相同功能的酶不是同工酶。同工酶具有相同或相似的活性中心,但其理化性质和免疫学性质不同。
1.3 核苷酸和核酸
1. DNA 的结构
中山大学生物化学考研复习笔记资料
本站小编 免费考研网/2015-10-13
相关话题/生物化学
2015年苏州大学生物化学621考研真题
 2015年苏州大学生物化学考研真题621 一、 名词解释4*5=20 1、 蛋白质的一级结构 2、 多酶复合物 3、 糖异生 4、 增色效应 5、 Wobble base pair 二、 问答(10*5 =50) 1、 简述DNA双螺旋结构的特点并试分析其对应的生物学意义。 2、 在糖代谢过程中生成的丙酮酸可进入哪些代谢途径 ...专业课考研资料 本站小编 免费考研网 2015-09-07
2015年苏州大学生物化学考研真题621 一、 名词解释4*5=20 1、 蛋白质的一级结构 2、 多酶复合物 3、 糖异生 4、 增色效应 5、 Wobble base pair 二、 问答(10*5 =50) 1、 简述DNA双螺旋结构的特点并试分析其对应的生物学意义。 2、 在糖代谢过程中生成的丙酮酸可进入哪些代谢途径 ...专业课考研资料 本站小编 免费考研网 2015-09-07生物化学教程王镜岩朱圣庚徐长法糖代谢
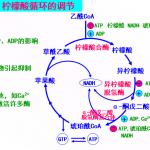 ⑴ 有氧氧化的调节通过对其关键酶的调节实现。⑵ ATP/ADP或ATP/AMP比值全程调节。该比值升高,所有关键酶均被抑制。⑶ 氧化磷酸化速率影响柠檬酸循环。前者速率降低,则后者速率也减慢。⑷ 柠檬酸循环与酵解途径互相协调。柠檬酸循环需要多少乙酰CoA,则酵解途径相应产生多少丙酮酸以生成乙酰CoA。 ...专业课考研资料 本站小编 免费考研网 2015-08-25
⑴ 有氧氧化的调节通过对其关键酶的调节实现。⑵ ATP/ADP或ATP/AMP比值全程调节。该比值升高,所有关键酶均被抑制。⑶ 氧化磷酸化速率影响柠檬酸循环。前者速率降低,则后者速率也减慢。⑷ 柠檬酸循环与酵解途径互相协调。柠檬酸循环需要多少乙酰CoA,则酵解途径相应产生多少丙酮酸以生成乙酰CoA。 ...专业课考研资料 本站小编 免费考研网 2015-08-25生物化学教程王镜岩朱圣庚徐长法氨基酸代谢
 n主要内容n蛋白质的生理功能和营养价值n蛋白质的消化、吸收与腐败n氨基酸的一般代谢n氨的代谢n个别氨基酸的代谢n ...专业课考研资料 本站小编 免费考研网 2015-08-25
n主要内容n蛋白质的生理功能和营养价值n蛋白质的消化、吸收与腐败n氨基酸的一般代谢n氨的代谢n个别氨基酸的代谢n ...专业课考研资料 本站小编 免费考研网 2015-08-25王镜岩-生物化学(第三版)配套练习及详解
第一章 蛋白质化学 I 主要内容 一、蛋白质的生物学意义 蛋白质是生物体内最为重要的有机化学物质之一,它几乎参与了生物体所有的生命活动,如生物体的构成、机体的运动、化学催化、机体的免疫保护、生物遗传信息的传递与表达等等,可以说蛋白质是一切生命活动的重要支柱,没有蛋白质就没有生命现象的存在,因此,蛋白 ...专业课考研资料 本站小编 免费考研网 2015-08-25中国农业大学2000-2009年406生物化学考研试题合集
中国农业大学406生物化学考研试题(2000-2009) 2000年406生物化学 一、是非题(每题1分,共10分) 1.蔗糖属于糖苷,无还原性。 2.甘油磷脂为双亲性分子,是由于其头部带有负电荷,尾部带正电荷。 3.同一生理条件下,同一种生物膜各区域分子流动性是相同的。 4.酶促反应自由能的变化值就是反应所需要的活化能 ...专业课考研资料 本站小编 免费考研网 2015-08-052015暨南大学712生物化学A(回忆版)考研真题
今年的生化A原题不少,于2013年之前相比多了一个题型。 一、根据英文简写写出中文名称(1*10=10) 1、Glu 2、FAD+ 3、ACP 4、cytC 5、TCA 6、His 7、FMN 8、SDS-PAGE 9、PCR 10、TPP 二、填空(2*20=40) 11年的第二题,第四题,10年第三题,第六题 ...专业课考研资料 本站小编 免费考研网 2015-08-04吉林大学王镜岩生物化学真题名词解释整理汇总
王镜岩生物化学名词解释(2013年~2002年) 【2013年】 1.寡聚蛋白质(oligomeric protein):两条或两条以上具有三级结构的多肽链组成的蛋白质。(也称多聚蛋白质)。如:血红蛋白(两条链,两条链)、己糖激酶(4条链)。 附:仅由一条多肽链构成的蛋白质称为单体蛋白质。如:溶菌酶 ...专业课考研资料 本站小编 免费考研网 2015-08-01王镜岩生物化学笔记(已排版)考研专用
第一章 蛋白质化学 教学目标: 1.掌握蛋白质的概念、重要性和分子组成。 2.掌握-氨基酸的结构通式和20种氨基酸的名称、符号、结构、分类;掌握氨基酸的重要性质;熟悉肽和活性肽的概念。 3.掌握蛋白质的一、二、三、四级结构的特点及其重要化学键。 4.了解蛋白质结构与功能间的关系。 5.熟悉蛋白质的重要性 ...生物医学笔记 本站小编 免费考研网 2015-07-222014年南京农业大学真题(生物化学+化学)
专业课考研资料 本站小编 网络资源 2015-07-19中科院612生物化学与分子生物学14年5年真题
2015中国科学院大学612《生化与分子生物》 一、名词解释(5*4) 流动镶嵌模型 糖酵解 严紧控制 酶专一性 小分子干扰RNA 二、单选(1*20) 印象当中好像都没见过 而且考的东西很细 个人认为有点偏 三、判断题(1*30) 好像也没什么太多重复的 四、简答题(4*5) 1、细胞膜结构在代谢中的作用 2、基因敲除与RNA干 ...专业课考研资料 本站小编 免费考研网 2015-07-15
